多囊卵巢综合征(PCOS)是育龄女性最常见的生殖内分泌代谢疾病之一,全球发病率约为6%-20%,我国育龄女性患病率达5.6%。近年来,干细胞技术凭借其免疫调节、组织修复和分化潜能,为PCOS治疗提供了新方向,相关基础研究与临床探索已取得阶段性进展。
一,多囊卵巢综合征(PCOS)
多囊卵巢综合征(PCOS)是一种以内分泌紊乱为核心、多系统受累的慢性疾病。从症状来看,PCOS的表现具有多样性。
除了月经不调,高雄激素相关症状最为直观。多毛常出现在上唇、下颌、乳晕周围、下腹正中线等男性化部位,部分患者还会出现头顶头发稀疏、发际线后移。
此外,约30%-70%存在胰岛素抵抗,表现为黑棘皮症(颈部、腋窝、腹股沟等褶皱处皮肤增厚、发黑)、血糖偏高或餐后血糖波动大。
PCOS的高发人群集中在15-49岁育龄女性,且呈年轻化趋势。其发病与遗传、环境密切相关。若未及时干预,不仅会导致不孕,还会增加远期健康风险, 如2型糖尿病、心血管疾病、子宫内膜癌,严重影响患者的生命周期健康。
目前临床针对PCOS的治疗以对症缓解为主,无法根治。例如,短效避孕药可能引发恶心、情绪波动,长期使用增加血栓风险;促排卵药物可能导致卵巢过度刺激综合征;辅助生殖技术不仅费用高,胚胎着床率仅25%-30%,且无法解决卵巢功能本身的病理问题。
因此,探索能从根源修复卵巢功能、改善代谢紊乱的治疗方式,成为PCOS临床研究的迫切需求。
二,干细胞治疗潜力
干细胞是通过多途径调节卵巢功能、改善全身代谢状态,从根源打破PCOS的病理循环:
1,修复卵巢局部微环境,恢复卵泡发育
PCOS患者卵巢存在颗粒细胞凋亡加速、卵泡闭锁增多、血管生成不足等问题,导致卵泡无法正常成熟。
干细胞可通过旁分泌效应释放血管内皮生长因子、胰岛素样生长因子-1等多种细胞因子,一方面促进卵巢内血管新生,改善组织血液供应,为卵泡发育提供充足营养;另一方面抑制颗粒细胞凋亡,上调卵泡发育关键基因的表达,推动原始卵泡向窦前卵泡、窦卵泡转化,恢复卵巢排卵功能。
动物实验显示,向PCOS大鼠模型移植干细胞后,其卵巢内闭锁卵泡数量减少40%以上,窦卵泡数量显著增加,血清促黄体生成素(LH)/促卵泡生成素(FSH)比值降低,排卵率提升近30%。
2,调节免疫炎症,改善胰岛素抵抗
慢性低度炎症与胰岛素抵抗是PCOS的核心病理环节,二者相互作用形成“炎症-胰岛素抵抗-雄激素升高”的恶性循环。
干细胞具备强大的免疫调节能力,可抑制巨噬细胞、T淋巴细胞活化,减少肿瘤坏死因子-α、白细胞介素-6等炎症因子分泌,缓解卵巢及全身炎症状态。同时,干细胞能上调胰岛素受体底物-1的磷酸化水平,增强脂肪、肌肉等外周组织对胰岛素的敏感性,降低血清胰岛素水平。
临床数据显示,接受干细胞治疗的PCOS患者,治疗后3个月血清炎症因子水平下降35%-50%,胰岛素抵抗指数(HOMA-IR)降低20%以上,部分患者可减少胰岛素增敏剂用量。
3,调控内分泌网络,降低雄激素水平
高雄激素血症是PCOS患者多毛、痤疮的主要诱因,根源在于卵巢间质细胞雄激素分泌过多。
干细胞可通过调节下丘脑-垂体-卵巢轴(HPO轴)功能,抑制垂体分泌 LH,减少LH对卵巢间质细胞的刺激,从而降低睾酮分泌;同时,其分泌的细胞因子能促进卵巢内芳香化酶活性,加速雄激素向雌激素转化,进一步降低血清雄激素水平。
临床观察发现,接受治疗的患者血清总睾酮、游离睾酮水平平均下降 25%-30%,多毛评分(Ferriman-Gallwey评分)从治疗前的10.1分降至6.3分,痤疮症状明显缓解。
三,临床研究

一篇由Chadwick Prodromos及其同事完成的研究文献,探讨了静脉输注脐带来源的间充质干细胞(UC-MSC)对多囊卵巢综合征(PCOS)的长期治疗效果。实验设计为一项临床研究,纳入了符合标准的PCOS患者,这些患者接受了脐带来源间充质干细胞的静脉输注,细胞经过体外扩增和质量控制以确保安全。
关键数据结果显示,治疗效果在输注后早期即开始显现并持续增强。特别是在第4个月的随访中,观察到了非常显著的临床症状改善,包括先前未曾报告的新毛发生长和原有毛发增厚,同时患者皮肤痘痘消失,这直观体现了雄激素水平的有效降低。
此外,激素水平趋于平衡,例如孕激素等关键指标恢复至正常范围,月经周期也随之恢复正常。超声检查在这一阶段也确认了卵巢结构的积极变化,显示多囊囊肿消失。
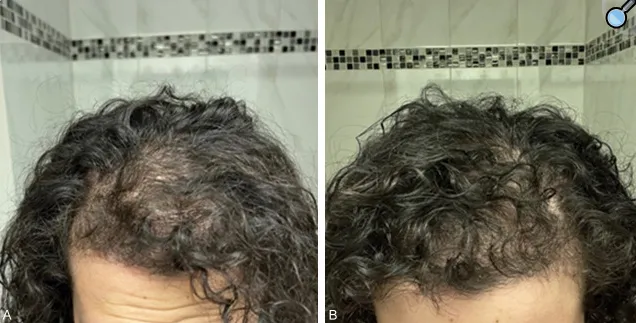
这些改善在后续的第6个月随访中得到进一步巩固和维持,数据显示血清抗穆勒氏管激素(AMH)和睾酮水平从基线的高值显著下降并趋于正常,卵巢体积缩小且卵泡数量正常化,超过80%的患者恢复了规律月经和自发排卵,且所有效果在整个观察期内保持稳定,未见反弹。安全性方面,未发生任何严重不良反应,如过敏、感染或肿瘤风险。
实验结论肯定,脐带间充质干细胞输注能够实现PCOS的根本性逆转,效果从早期的明显症状改善到第6个月的持久生理功能恢复,证明了其超越传统症状管理方法的潜力。这种作用可能源于干细胞的免疫调节、抗炎及组织修复特性,从而重塑卵巢微环境与激素平衡。
研究者认为该疗法为PCOS提供了新的根治性策略方向,但同时也强调需开展更大规模、更长周期的随机对照试验以最终确认其长期疗效与安全性,并深入阐明其作用机制。总体而言,该研究为干细胞疗法应用于内分泌疾病领域提供了强有力的临床证据,展现出广阔的转化医学前景。
另一篇由Mahta Hadidi等人共同完成的文献综述,旨在探讨干细胞及其分泌的外泌体作为新型生物制剂,在诊断和治疗多囊卵巢综合征(PCOS)中的应用潜力。
研究人员在综述中系统分析了多项临床前研究和初步的临床研究数据。实验过程主要涉及从不同来源提取间充质干细胞,并将其直接移植到患有PCOS的实验动物体内,或提取这些干细胞在培养过程中释放的外泌体进行干预。
一组典型的数据显示,在接受干细胞或其外泌体治疗后,PCOS模型动物的血清雄激素水平显著下降(约30-50%),同时胰岛素抵抗情况得到改善,血糖和胰岛素水平趋于正常。
此外,卵巢形态学观察显示,治疗后的动物卵巢中囊状卵泡数量减少,健康卵泡比例增加,甚至恢复了规律的排卵周期。这些数据从功能学和形态学两方面证明了治疗的有效性。
在作用机制方面,研究者认为干细胞和外泌体主要通过调节免疫炎症反应、减少卵巢局部纤维化、促进血管生成以及恢复受损细胞的正常功能来实现治疗效果。
外泌体作为细胞间的通信载体,能够将有益的分子信号传递给受损的卵巢细胞,从而抑制过度雄激素的合成,改善卵泡发育环境。
基于现有证据,作者认为,干细胞疗法尤其是其衍生的外泌体,为PCOS的诊断和治疗提供了创新方向。它们不仅有望用于恢复卵巢的正常生理功能、改善代谢指标,还可能作为生物标志物辅助诊断。
干细胞技术及其衍生的外泌体疗法,在多囊卵巢综合征的治疗中,展现出令人瞩目的潜力,从根源上改善卵巢功能、调节代谢与内分泌,为患者带来了新的希望。未来,随着研究的不断深入,干细胞疗法有望成为PCOS治疗的重要里程碑,为全球育龄女性带来更加健康、美好的生活。
免责声明:凡本平台转载的文章、图片、音频、视频等资料的版权均归版权所有人所有,如有侵权,请联系我们删除,带来不便,敬请谅解!我们旨在科普相关知识,传递行业前沿进展,本文观点不作为医疗指导建议,无推荐公司和医院之意,如需就医请咨询正规医院医生。
