对于全球数百万1型糖尿病患者而言,指尖采血、胰岛素注射和血糖监测构成了他们与疾病共生的日常。尽管胰岛素替代疗法已拯救无数生命,但无法阻止糖尿病肾病、视网膜病变等并发症的侵蚀。近年来,以干细胞为核心的再生医学领域取得重大突破,正推动治疗范式从单纯的血糖控制向功能重建转变。
一,1型糖尿病
1型糖尿病是一种慢性代谢性疾病,其主要特征是胰腺β细胞因免疫系统攻击而受损,导致胰岛素分泌不足。由于胰岛素是调节血糖的关键激素,缺乏胰岛素会使血糖水平异常升高,从而引发一系列健康问题。
1,病因与发病机制
1型糖尿病被认为是一种自身免疫性疾病。即免疫系统会错误地攻击并破坏胰腺中负责产生胰岛素的β细胞。这种攻击可能由遗传因素、病毒感染或环境因素引发。尽管其具体机制尚未完全阐明,但有研究表明,遗传易感性和外部触发因素共同作用,导致了该疾病的发生。
2,临床表现
1型糖尿病的症状通常发展迅速,患者会出现多饮、多尿、体重下降、极度饥饿、疲劳、视力模糊等表现。其中,多饮、多尿、多食和体重减少这组症状被称为“三多一少”。这些症状的出现,是因为高血糖导致身体无法有效利用葡萄糖,进而引发脱水与能量不足的状况。此外,若不及时进行治疗,患者可能会因酮症酸中毒(DKA)等严重并发症而危及生命。
3,诊断
1型糖尿病的诊断主要依据临床表现和实验室检查。常用的检测方法包括血糖水平测试(如空腹血糖或随机血糖)、糖化血红蛋白检测以及胰岛素水平评估。此外,血清C-肽水平的测定也被用于区分1型和2型糖尿病。
二,干细胞治疗的作用机制
1,多向分化潜能
干细胞(如间充质干细胞、诱导多能干细胞)通过多向分化潜能生成功能性胰岛β细胞,直接补充因自身免疫破坏而缺失的细胞。例如化学重编程多能干细胞(CiPS细胞)在移植后可恢复胰岛素分泌,胚胎干细胞和诱导多能干细胞(iPSCs)在体外分化为胰岛素分泌细胞且基因表达接近成熟β细胞,临床试验显示移植后能长期控制血糖并减少胰岛素依赖。
2,免疫调节作用
干细胞凭借其独特的免疫调节特性,在纠正自身免疫异常方面发挥着关键作用。一方面,它们可有效诱导调节性T细胞(Treg)发生定向增殖,进而增强Treg细胞的免疫抑制功能,抑制过度的免疫应答;另一方面,干细胞能够抑制促炎因子的产生及相关免疫细胞的活性,例如显著降低M1型巨噬细胞的促炎极化水平,从源头上减少炎症因子的释放和免疫损伤;同时,干细胞还积极促进抗炎因子的分泌与释放,营造局部或全身的抗炎微环境。
3,旁分泌效应
干细胞可主动分泌血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)等多种生物活性因子。这些因子协同作用,作用于胰腺残余β细胞,激活相关信号通路,促进β细胞增殖,同时为其营造适宜生存环境,减少凋亡,提升β细胞存活率。此外,它们还能改善胰腺局部微环境,抑制成纤维细胞过度活化,减少细胞外基质沉积,减轻纤维化,增强血管化,保障胰腺组织氧气与营养供应。
三,临床研究

2024年,中国研究团队在《Cell》杂志上发布了一项具有里程碑意义的研究成果——全球首例通过腹直肌前鞘下移植化学诱导多能干细胞(CiPSC)来源的胰岛细胞治疗1型糖尿病的临床试验。该研究由天津市第一中心医院沈中阳、王树森团队与北京大学昌平实验室邓宏魁团队等携手合作完成。
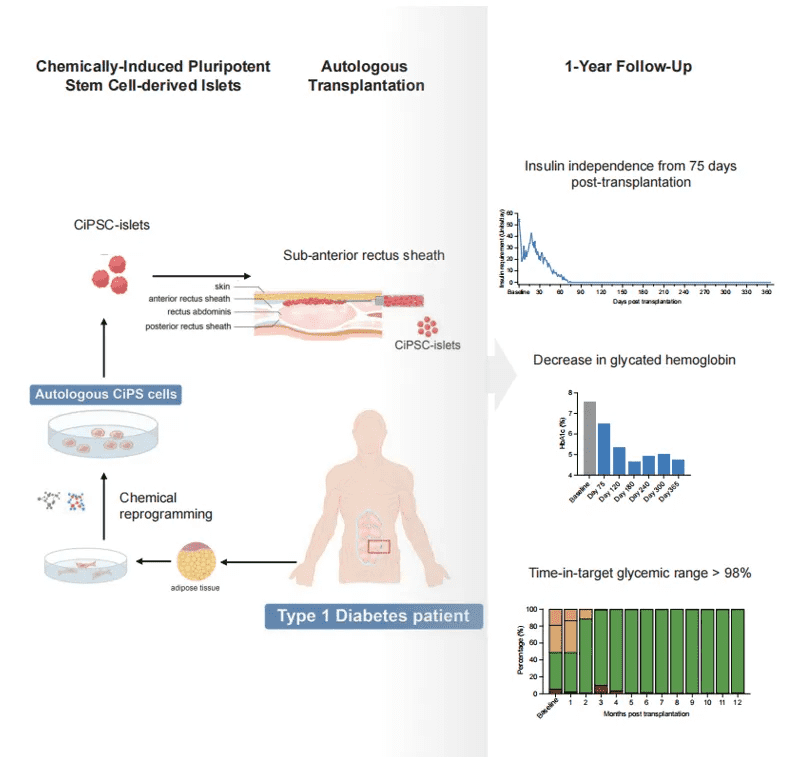
此次临床试验的受试者是一名有着11年1型糖尿病病史的患者。此前,该患者曾接受过胰腺移植手术。但手术失败了,且其体内存在强阳性群体反应抗体,这使得他无法接受异体胰岛移植。在移植手术前,患者的血糖达标率(TIR)仅为43.18%,还频繁出现危及生命的低血糖状况,生活质量受到严重影响。
研究团队采用了先进的化学小分子重编程技术,将患者自身的成体细胞(例如脂肪间充质干细胞或皮肤成纤维细胞)转化为多能干细胞。随后,通过精心设计的四阶段分化策略,对这些多能干细胞进行定向诱导,使其逐步发育成为具有功能的胰岛细胞。
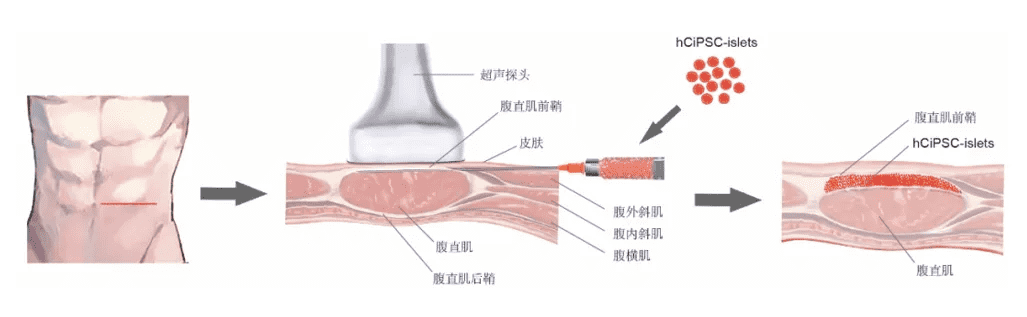
在供体测试阶段,重编程效率处于0.21%-2.56%的范围内。最终制备完成的胰岛细胞,通过一种新型移植位点——“腹直肌前鞘下”植入患者体内。值得一提的是,该移植位点此前已在非人灵长类实验中得到了验证,被证实能够有效维持胰岛细胞的存活与正常功能。
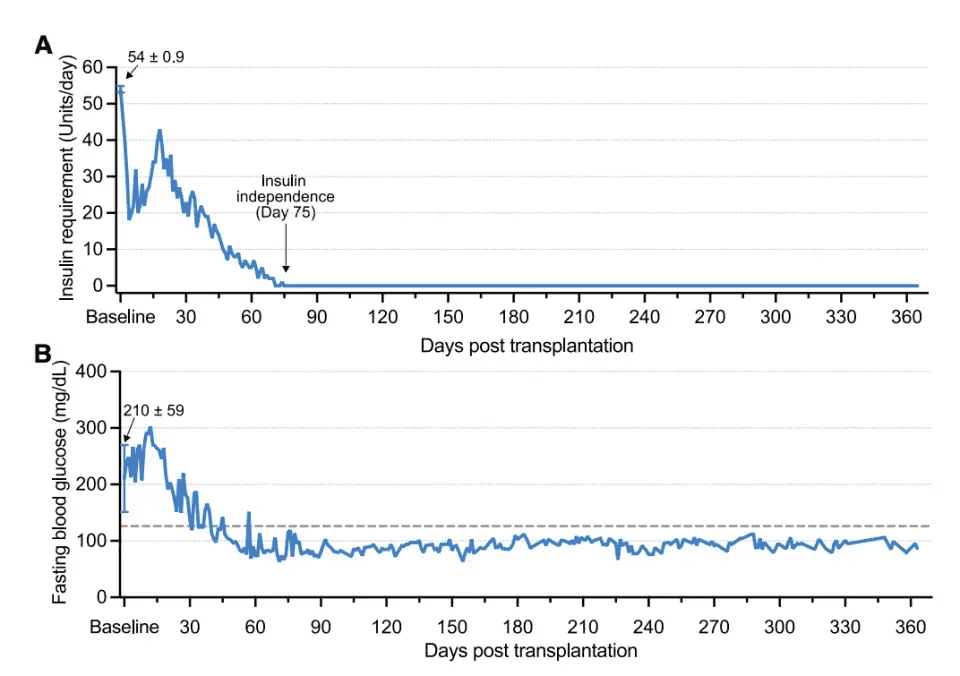
2023年6月25日,患者顺利接受了移植手术。术后,患者的外源胰岛素需求量呈现出持续下降的趋势,到第75天时,患者已完全摆脱了对胰岛素的依赖,且这种无胰岛素治疗的状态已维持超过1年。关键的临床数据显示,术后4个月,患者的血糖达标率(TIR)大幅提升至96.21%;术后5个月,该指标稳定在98%以上。同时,患者的糖化血红蛋白(HbA1c)水平从基线值显著下降至4.76%,达到了非糖尿病患者的正常水平。
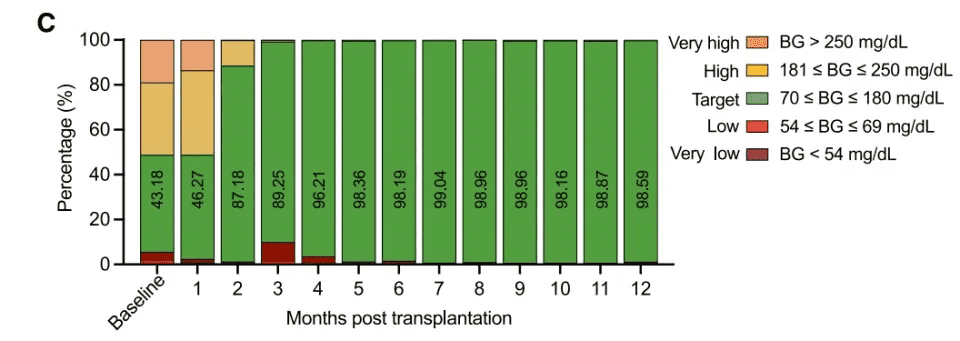
在术后一年的随访中,患者的空腹血糖、餐后血糖以及C肽分泌等指标均恢复正常,且在整个治疗过程中,患者未出现任何与移植相关的不良反应,各项研究终点均得以满足。这一成果标志着1型糖尿病功能性治愈领域取得了重大突破,特别是有效解决了传统胰岛移植中面临的供体短缺和免疫排斥这两大难题。
该研究首次在临床环境中验证了CiPSC衍生胰岛细胞的长期安全性和有效性。目前,研究团队已制定了后续计划,打算扩大样本量,并进一步优化胰岛细胞的制备流程,以加速推动该疗法向临床应用的转化进程。这项研究为全球超过460万1型糖尿病患者带来了新的治疗希望,同时也为干细胞衍生组织移植策略在再生医学领域的应用树立了重要的里程碑。
干细胞疗法的突破为1型糖尿病治疗开启了全新篇章,从“血糖控制”迈向“功能重建”的医学革命正在成为现实。未来,随着技术优化与临床试验的推进,这一疗法有望颠覆传统治疗范式,为全球数百万患者提供更安全、更持久的解决方案。
免责声明:凡本平台转载的文章、图片、音频、视频等资料的版权均归版权所有人所有,如有侵权,请联系我们删除,带来不便,敬请谅解!我们旨在科普相关知识,传递行业前沿进展,本文观点不作为医疗指导建议,无推荐公司和医院之意,如需就医请咨询正规医院医生。
